Transferrin (Eisentransportprotein)
Transferrin (lat. trans=hinüber, ferrum=Eisen) ist ein eisenbindendes Protein, dass für den Eisentransport im Organismus zuständig ist. Dieses Glykoprotein (Proteinkette mit Zucker-Resten) besteht aus 679 Aminosäuren und hat zwei Bindungsstellen für Fe3+-Ionen. Transferrin wird in der Leber hergestellt und gehört zur Gruppe der β-Globuline (Transportproteine). Zu viel Eisen im Organismus ist schlecht, zu wenig auch. Transferrin sorgt für einen ausgewogenen Eisenhaushalt. Die folgende Grafik zeigt den Transferrin-Zyklus:
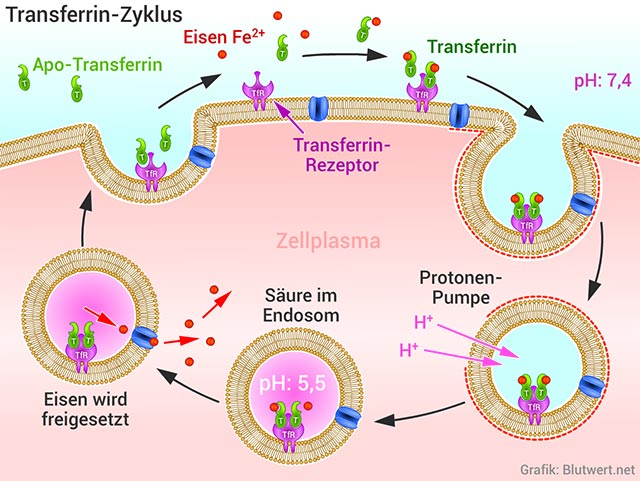
Eisen im Organismus
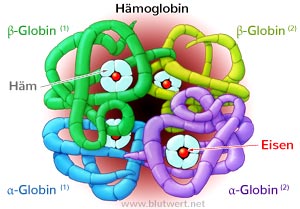
Häm-Gruppe, deren Eisen-Endung
Sauerstoff binden kann
Transferrin ist ein wesentlicher Bestandteil des Eisenstoffwechsels. Das Spurenelement Eisen (ferrum) wird im menschlichen Körper vor allem für Hämoglobin benötigt. Hämoglobin wiederum ist Hauptbestandteile der Erythrozyten (rote Blutkörperchen). Wegen des rötlichen Eisens sieht auch Blut rot aus. Das Eisen im Hämoglobin kann Sauerstoff (und Kohlenstoffdioxid) binden. Auf diese Weise wird Sauerstoff (=Energie) aus der Lunge über den Blutkreislauf in alle Organe und Gewebe transportiert.
Vereinfacht ausgedrückt: ohne Eisen keine Energie.
Funktion des Transferrins: Eisentransport im Organismus
Die Lagerung und der Transport von Eisen im Organismus ist von wichtiger Bedeutung. Eisen wird im Organismus zwar auch recycelt (wiederverwendet), allerdings muss ein Teil über die Nahrung aufgenommen werden.
Beim Abbau des Hämoglobins in der Milz (und in geringem Umfang auch in der Leber) wird Eisen herausgelöst und an Transferrin gebunden. Der Rest (erst Biliverdin, dann Bilirubin) wird dann über die Leber entsorgt.
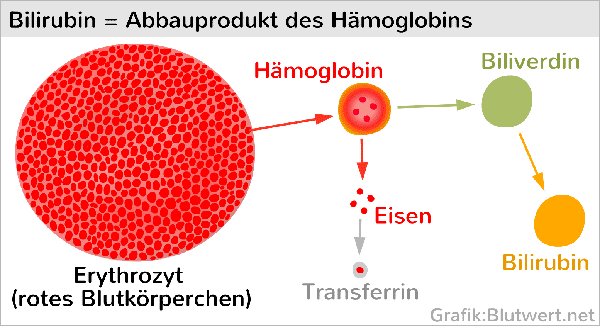
Darüber hinaus wird Eisen vor allem zum Aufbau von Körperzellen benötigt (Wachstum).
Wenn zu wenig Eisen zur Verfügung steht - sei es aufgrund von Mangelernährung oder aufgrund verminderter Transferrinsättigung, kann nicht mehr ausreichend Hämoglobin gebildet werden. Man spricht von einer Eisenmangelanämie.
Eisenspeicherung und -transport
Transferrin wird hauptsächlich in der Leber produziert; geringe Mengen werden außerdem in den Hoden, im Gehirn, der Milz und den Nieren gebildet. Mit vier Prozent Anteil im Plasmaprotein ist Transferrin das vierthäufigste Protein im Blutplasma.
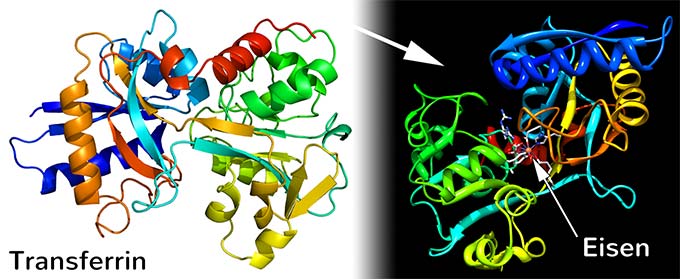
mit Eisen im Zentrum
Transferrin Normalwerte / Blutwert
Das in Transferrin gebundene Eisen beträgt ca. 0,1 % des gesamten Eisens im menschlichen Organismus. Bei voller Sättigung kann das Plasmatransferrin ca. 12 mg Eisen aufnehmen, eine vergleichsweise kleine Menge. Transferrin ist im Normalfall nur zu rund 20 bis 40 Prozent mit Eisen besetzt. Als Normalwerte gelten 2 bis 6 Gramm.
Wenn der Sättigungsgrad (bis zu 45%) überschritten wird, kann Eisen nicht mehr gebunden werden. Es schwimmt dann frei im Blut (ebenfalls als Blutwert messenbar) - bei längerem erhöhten Eisengehalt im Blut kommt es zu Vergiftungserscheinungen.
Die normale Eisen-Transferrinsättigung des Erwachsenen liegt bei etwa 25–30 %.
Der Referenzbereich des Transferrinspiegels (Transporteisen) im Laborbefund liegt beim Menschen bei 200–400 mg/dl (Milligramm pro Deziliter).
Transferrin erhöht / zu hoch
Eine Erhöhung des Transferrinspiegels über 400 Milligramm pro Deziliter zeigt an, dass der Eisenhaushalt etwas aus dem Lot ist. Ursachen können sein:
- Eisenmangel, mögliche Ursachen:
- Mangelernährung, zu wenig Spurenelemente in der Nahrung
- Darmerkrankungen wie z. B. Morbus Crohn; dadurch kann nicht genügend Eisen aus der Nahrung aufgenommen werden
- Schwangerschaft: Das Wachstum des Fötus muss von der Mutter bewältigt werden. Das verbraucht (u.a.) auch viel Eisen.
- Blutverlust, Monatsblutung, Menstruation: durch den Blutverlust geht auch Transferrin verloren.
Siehe auch: Eisenmangelanämie.
Transferrin vermindert / zu niedrig
Wenn der Transferrin-Wert unter 200 mg pro Deziliter sinkt, kommen verschiedene Ursachen in Frage. Mögliche Ursachen sind:
- Eisenspeicherkrankheit (Hämochromatose), Eisenüberladung: Aufgrund der verstärkten Eisenaufnahme im oberen Dünndarm kann es so zu einem Gesamtkörpereisengehalt von bis zu 80 g kommen (normal: ca. 2–6 g). Diese Überladung führt im Laufe der Jahre zu Organschädigungen, insbesondere von Leber, Bauchspeicheldrüse, Herz, Gelenken, Milz, Hirnanhangsdrüse, Schilddrüse und Haut.
- chronische Entzündung
- Tumorerkrankung
- Störung der Leberfunktion: da Transferrin hauptsächlich in der Leber gebildet wird, können Störungen dieses Organs (z.B. Hepatitis oder Leberzirrhose) den Transferrinwert vermindern.
- Hämolyse: vermehrter krankhafter Abbau von roten Blutkörperchen
- Bluttransfusionen
- akute Entzündung: Transferrin ist ein Anti-Akute-Phase-Protein: im Falle einer Entzündung wird Transferrin gebunden, wodurch die Transferrin-Konzentration abnimmt.
Wer hat Transferrin entdeckt?
Als Entdecker des Transferrins gelten Arthur L. Schade und Leona Caroline von der Overly Biochemical Research Foundation in New York City. Sie veröffentlichten 1946 in Science einen Artikel über ihre Entdeckung
Quellen
- Wikipedia: Transferrin
- Bildquellen: Protein TF von Emw, Transferrin von Geoman3
- Charité: Transferrin
- Ärzteblatt: Neue Parameter zur Diagnostik von Eisenmangelzuständen: Retikulozytenhämoglobin und löslicher Transferrinrezeptor
Weiterführende Links
Weitere interessante Artikel
Mikrozytäre Anämie

https://www.blutwert.net/anaemie/mikrozytaere-anaemie.php
Eine mikrozytäre Anämie ist eine spezielle Form der Anämie ("Blutmangel"). Sie tritt meist infolge von Eisenmangel oder bei Problemen mit der Nutzung des Eisens im Körper auf. Dann kann die sog. Häm-Gruppe

